打一针就可修复受损心脏,“癌症克星”CAR-T跨界疗法登上Science封面
用新冠病毒疫苗的方式修复心脏纤维化
博雯 发自 凹非寺
量子位 报道 | 公众号 QbitAI
用“打疫苗”的方式修复心脏损伤,你能想象吗?
这项来自宾夕法尼亚大学的研究,现已登上Science封面:

已存的一些疗法常常会在体外培养特殊的靶向细胞,然后重新注入患者体内。
但这种新方法,则是通过注射一种特殊的mRNA,直接在小鼠体内编译免疫细胞,使其攻击特定目标。
作者表示,这种“注射式”的疗法与新冠病毒疫苗的技术存在着相似之处。

接下来,就一起来看看他们是怎么做到的。
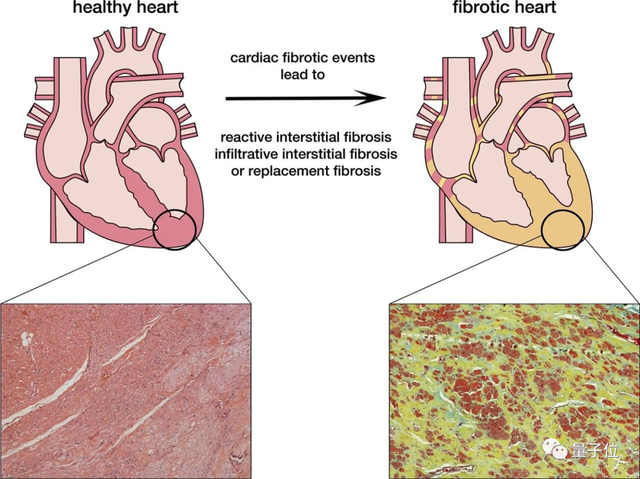
纤维化的心脏
首先我们要知道,在各种心肌受损发生时,人体内的一种叫做心肌成纤维细胞(Cardiac Fibroblasts)会被激活。
这一细胞能够分泌纤维物质,有益于伤口的愈合,但如果纤维物质长期分泌过量,也会导致心脏组织变硬,损害心脏正常功能。
这也就是我们常常听到的纤维化。
这时,一种叫做CAR-T的技术就进入了大家的眼中。
CAR-T是一种近几年新出现的癌症疗法,由宾夕法尼亚大学和诺华公司共同开发。今年6月,我国就首次批准了一款CAR-T细胞治疗产品。
这项技术的流程简单来说,就是将患者体内的T细胞取出,在实验室中进行基因重编译、修饰、增殖,再重新注入患者体内攻击特定的细胞类型。
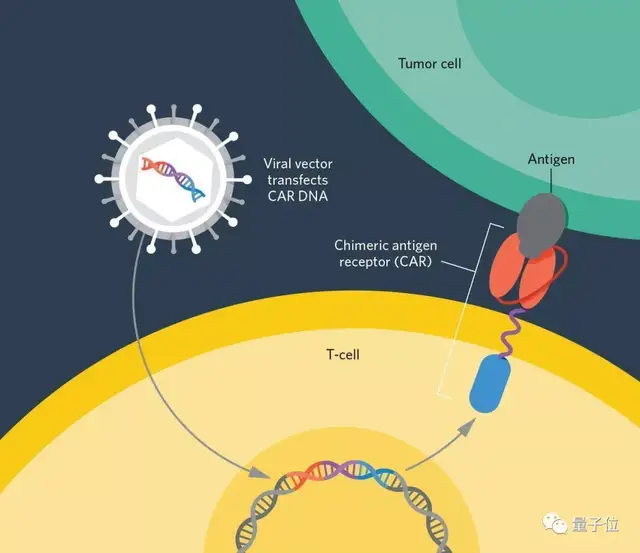
然而在用于纤维化等疾病的治疗时,却会出现一种情况:
通过体外重新编译的CAR-T细胞即使在完成了它的任务,也就是攻击心肌成纤维细胞,使其不再或减弱分泌纤维物质之后,仍然可以在患者体内存活数月,甚至数年。
就像我们上面所说的一样,纤维物质多了当然不行,但少了也是会影响伤口愈合的。
更何况,体外培养还总是存在着各种不可控因素。
针对这些问题,论文作者Drew Weissman表示:
标准化的CAR-T疗法需要在患者体外修饰T细胞,这个过程较为昂贵,并且难以拓展至更多普通的疾病。
所以,他们选择把这场基因重编译直接挪到体内。
挪到体内的基因重编译
研究团队首先设计了一种mRNA,使其靶向活跃的成纤维细胞的T细胞受体。
然后,基于mRNA疫苗的思路,将他们设计的mRNA封装在微小的、类似气泡的脂质纳米颗粒(LNPs)中,再向心衰的小鼠体内注射:
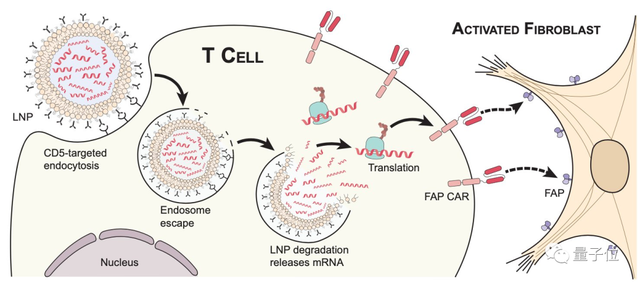
包裹着特殊mRNA的脂质纳米颗粒进入体内后,会将被T细胞捕获。
然后,封装的mRNA就会转化为功能蛋白,使T细胞获得特异性靶向攻击心肌成纤维细胞的能力。
到这一步,本来要在体外进行编译修饰才能产生的CAR-T细胞,直接在体内自动合成了。
可以观察到,在40分钟和85分钟时,FAP CAR-T细胞就已经形成了免疫突触:
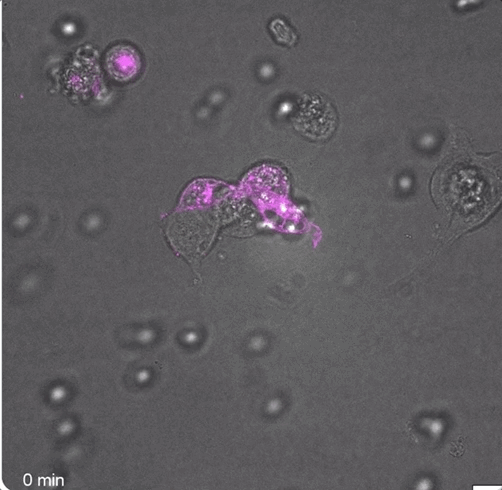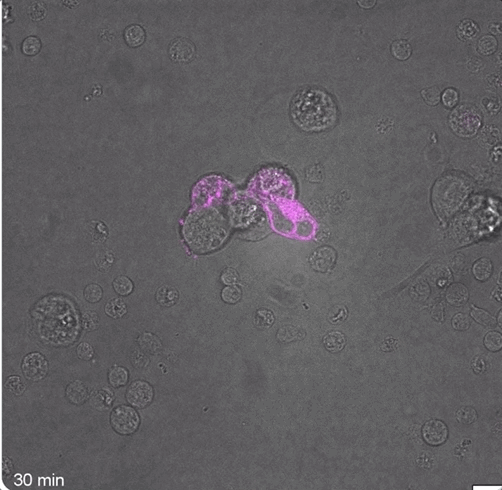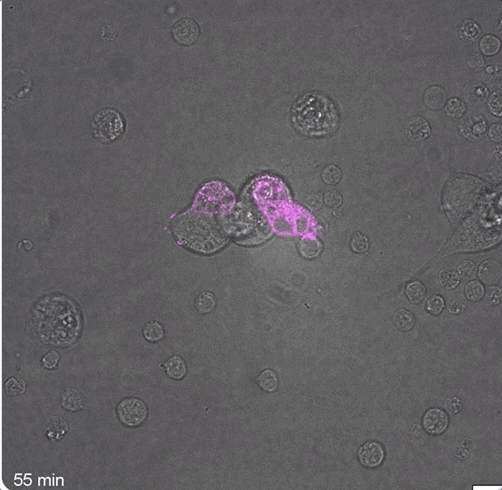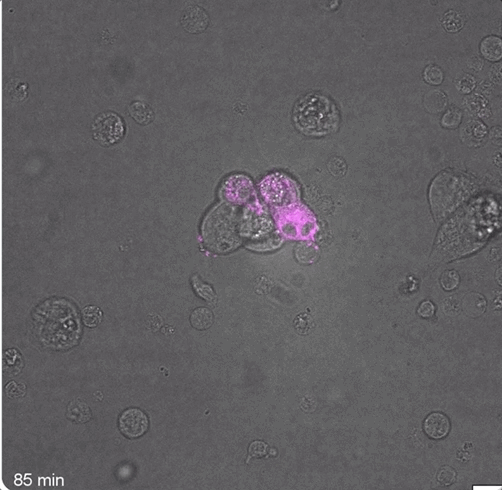
而大量数据也表明,在注射成功后,小鼠体内确实瞬时产生了FAP CAR-T细胞:
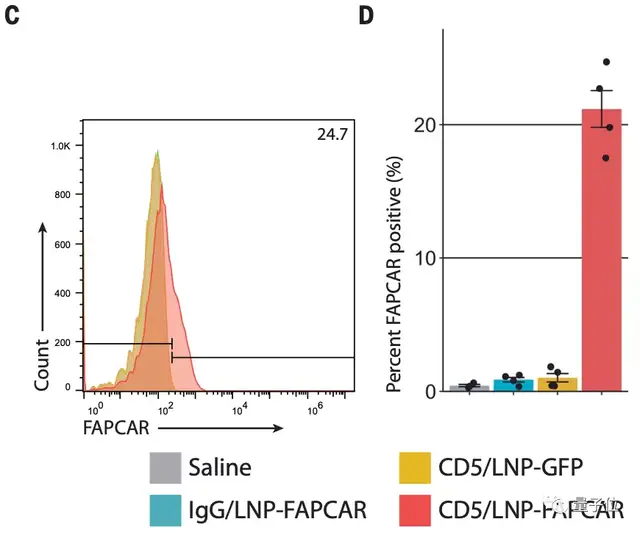
随后,研究人员通过回声心动图分析不同组的小鼠心脏功能,然后发现,这些暂时产生的FAP CAR-T细胞确实一定程度上减少了心衰小鼠的心脏纤维化:
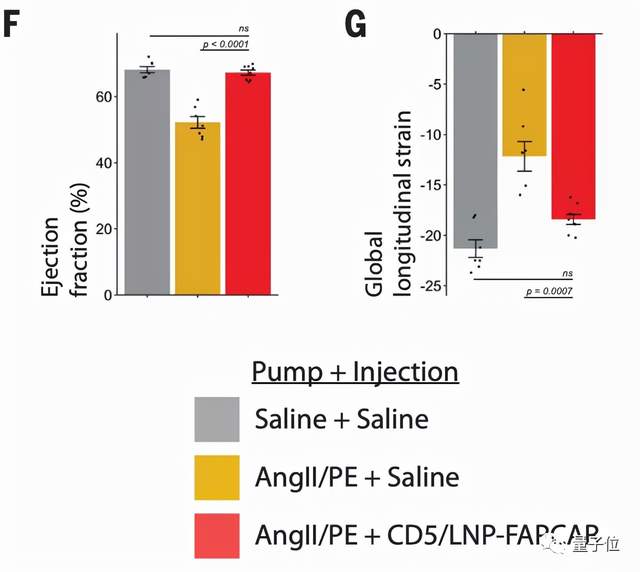
△灰:健康 黄:受损 红:受损且产生FAP CAR T细胞
而这种体内编码合成的mRNA只能在T细胞内存活几天,也就是说,不会影响到成纤维细胞的正常功能。
研究人员正在做进一步的研究,以希望该工作能够尽快应用到临床上。
作者介绍
这篇论文来自宾夕法尼亚大学医学院,Jonathan a. Epstein领导的团队。
Jonathan a. Epstein是医学院教授,主要研究领域在心血管、干细胞和心脏发育上。

论文:
https://www.science.org/doi/10.1126/science.abm0594
参考链接:
https://www.eurekalert.org/news-releases/939267
- 有道智能学习灯发布,通过“桌面学习分析引擎”实现全球最快指尖查词2022-04-08
- 科学证明:狗勾真的懂你有多累,听到声音0.25秒后就知道你是谁,对人比对狗更亲近2022-04-14
- 在M1芯片上跑原生Linux:编译速度比macOS还快40%2022-04-05
- 小学生们在B站讲算法,网友:我只会阿巴阿巴2022-03-28





